Молекула, собранная из фрагментов трёх разных белков, отвлекает ВИЧ от иммунных клеток, помогая его уничтожить.
На сегодняшний день число излечившихся от СПИД’а можно в буквальном смысле пересчитать по пальцам одной руки.
Несмотря на то, что эффективность антиретровирусной терапии, направленной против ВИЧ, повышается, у вируса по-прежнему остаётся два неубиваемых козыря:
он умеет надолго засыпать в иммунных клетках, ничем не выдавая своего присутствия, и может похвастаться высокой вариабельностью, так что иммунитет просто не успевает выработать антитела к вирусным белкам, настолько быстро они меняются.
Частицы ВИЧ.
На самом деле человеческий организм способен синтезировать антитела, которые могут «поймать» 90% появляющихся разновидностей ВИЧ. Такие иммуноглобулины назвали антителами широкого спектра действия и начали активно изучать.
Если заставить иммунную систему своевременно синтезировать антитела широкого спектра действия, то ВИЧ можно будет обезвредить; правда, оказалось, что задача это не из простых – возникают они редко и с большой задержкой, и вакциной их простимулировать нельзя.
С другой стороны, в 2013 году в Nature было опубликовано сразу две статьи, в которых говорилось, что коктейль антител широкого спектра действия можно вводить в готовом виде в организм, и тем самым подавлять вирус до почти неразличимого состояния.
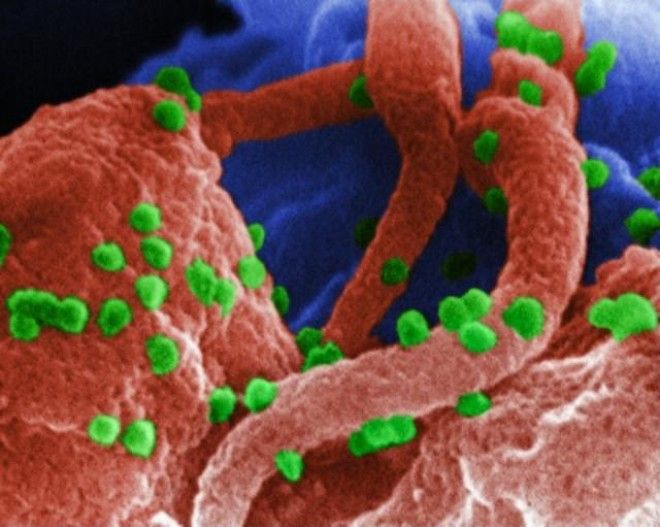
Частицы ВИЧ на поверхности лимфоцита.
Исследователи создали искусственный белок, блокирующий взаимодействие вирусных частиц с иммунной клеткой. Чтобы прилипнуть к клетке, ВИЧ использует собственный белок под названием gp120, который сначала прикрепляется к рецептору CD4 на клеточной мембране. То есть для успешного заражения ВИЧ должен использовать две «посадочные площадки» на поверхности клетки.
Майкл Фарзан (Michael Farzan) и три десятка его коллег соединили по куску от обоих мембранных рецепторов с фрагментом иммуноглобулина. Получившаяся конструкция (под названием eCD4-Ig) отвлекала вирус на себя, а благодаря фрагменту антитела вирус обезвреживался.
Как утверждают авторы работы, их белковая химера превосходила по антивирусным свойствам все известные варианты природных антител – в присутствии eCD4-Ig ВИЧ не мог проникнуть в клетку.
Чтобы проверить, как белок будет действовать в организме, ДНК с информацией о eCD4-Ig вставили в безвредный аденоассоциированный вирус, который, хотя и проникает в клетки человека и других приматов, никакого заболевания не вызывает и иммунную систему почти не беспокоит.
В данном случае аденоассоциированный вирус послужил курьером, доставившим ген искусственного антиВИЧ белка в клетки макак резуса. Белок синтезировался у макак в течение 34 недель и весьма эффективно очищал организм от обезьяньего варианта ВИЧ, который животным специально вводили в больших дозах.
В теории вирусу будет трудно защититься от сложносочинённого искусственного белка: взаимодействие с рецепторами CD4 и CCR5 для ВИЧ жизненно важно, так что промутировать свой контактный белок gp120 так, чтобы не попадать в ловушку, ему вряд удастся – ведь в таком случае ему придётся искать новый «вход» в клетку, а это даже для сверхвариабельного вируса не так просто.
Конечно, результаты ещё нужно подтвердить в более масштабных опытах (пока что эксперимент был поставлен всего с несколькими обезьянами); кроме того, медицинские перспективы химерного белка станут окончательно ясны только после исследований на людях.

